初中化学酸碱盐知识归纳
发布时间:2011-09-22 11:36:49来源:查字典-中考网
成都查字典中考网10月8日
中学化学中常见酸的特性
1、不稳定性酸
这部分酸包括H2CO3、H2SO3、HCIO、HNO3(浓)、H4SiO4、氢硫酸(H2S)、氢碘酸(HI)、氢硒酸(H2Se)、氢碲酸(H2Te)等。
(1)常温(或微热)易分解的酸:H2CO3、H2SO3、HNO3(浓)、H4SiO4等。
(2)见光易分解的酸:HCIO、HNO3(浓)。
(3)易被氧气氧化而变质的酸:H2S、HI、H2SO3、H2Se、H2Te等。
2、强氧化性酸
这部分酸包括浓HNO3、稀HNO3、浓H2SO4、HCIO等,它们的强氧化性主要表现在以下几个方面。
(1)常温下,浓H2SO4、浓HNO3能使Fe、AI等金属发生钝化。
(1)
能氧化大多数的金属单质(Au、Pt除外)。
(3)能氧化部分非金属单质(如S、C、P、I2等)。
3、强还原性酸
这部分酸包括H2S、HI、H2SO3、H2Se、H2Te、H3PO3、HBr、H3ASO3等。
4、易挥发的酸
这部分酸包括HF、HCI、HBr、HI、浓HNO3等。
5、高沸点、难挥发性酸
这部分酸包括浓H2SO4、浓H3PO4等。
6、具有漂白性的酸
这部分酸包括HCIO、H2SO3等。
7、具有强吸水性的酸
这种酸是浓H2SO4,浓H2SO4可作气体干燥剂。
8、具有脱水性的酸
这部分酸包括浓H2SO4、浓H3PO4。
9、能腐蚀玻璃的酸
这种酸是氢氟酸(HF)。
10、有剧毒的酸
这部分酸包括HF、HPO3(偏磷酸)、HCN。
11、能溶解铂、金的酸
这种酸是王水(浓硝酸和浓盐酸组成的混合物)。
12、不溶于水的酸
这部分酸包括H2SiO3、H4SiO4,硬脂酸、软脂酸、油酸。
13、能与酸发生反应的酸
这部分酸包括H2S、HI、HBr、氨基酸等,H2S、HI、HBr遇强氧化性酸能发生氧化还原反应,氨基酸中存在碱性基团氨基(-NH2)。
14、遇氨气能冒白烟的酸
这部分酸包括浓盐酸、浓硝酸、醋酸等,即它们挥发出来的酸与氨气反应生成相应的铵盐(固体)的缘故。
15、可用于制造炸药的酸
硝酸可用于制取硝化甘油、三硝基甲苯(TNT)、硝酸纤维等烈性炸药。
16、能发生显色反应的酸
浓HNO3遇含苯环的蛋白质会显黄色;苯酚与FeCI3溶液反应生成紫色的物质。
17、能发生银镜反应的酸
甲酸(HCOOH)能发生银镜反应。
18、能发生酯化反应的酸
无机含氧酸和有机羧酸。
19、与苯环能发生取代反应的酸
浓HNO3、浓H2SO4可发生此类反应。
20、能作催化剂的酸
浓、稀H2SO4、H3PO4、浓盐酸等,例如浓H2SO4可作硝化反应、酯化反应、水解反应等的催化剂,磷酸是乙烯水化法的催化剂,浓盐酸是制取酚醛树脂的催化剂等。
一、酸、碱、盐的组成
酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)
碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(NH3H2O)
盐是由金属元素元素(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠
酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)
二、酸
1、浓盐酸、浓硫酸的物理性质、特性、用途

2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)
(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色
(2)金属+酸盐+氢气
(3)碱性氧化物+酸盐+水
(4)碱+酸盐+水
(5)盐+酸另一种盐+另一种酸(产物符合复分解条件)
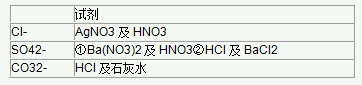
3、三种离子的检验
三、碱
1、氢氧化钠、氢氧化钙的物理性质、用途

2、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)
(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色
(2)酸性氧化物+碱盐+水
(3)酸+碱盐+水
(4)盐+碱另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)
注:①难溶性碱受热易分解(不属于碱的通性)
如Cu(OH)2CuO+H2O
2Fe(OH)3Fe2O3+3H2O
②常见沉淀:AgClBaSO4Cu(OH)2Fe(OH)3Mg(OH)2BaCO3CaCO3
③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
四、中和反应溶液酸碱度的表示法--pH
1、定义:酸与碱作用生成盐和水的反应
2、应用:
(1)改变土壤的酸碱性
(2)处理工厂的废水
(3)用于医药
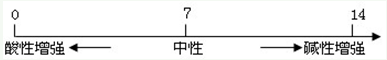
3、溶液酸碱度的表示法--pH
(1)
(2)pH的测定:最简单的方法是使用pH试纸
用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)
(3)酸雨:正常雨水的pH约为5.6(因为溶有CO2)
pH5.6的雨水为酸雨
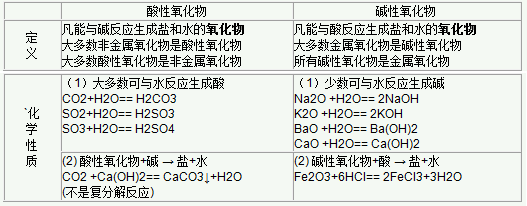
五、酸性氧化物与碱性氧化物
初中化学酸碱盐知识归纳
一、概念:
1、酸的组成--氢离子+酸根离子
2、碱的组成--金属离子+氢氧根离子
3、盐的组成--金属离子+酸根离子
4、复分解反应--由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。AB+CD=AD+CB
5、稀释浓硫酸的方法--一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。
6、中和反应--酸跟碱作用生成盐和水的反应叫做中和反应。
二、熟记常见元素和原子团的化合价口诀:
(正价)一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷。
(负价)负一价:氟、氯、溴、碘;
负二价:氧和硫。
(可变正价):一二铜汞,二三铁,二四碳,四六硫。
(原子团的化合价
负一价:氢氧根(OH),硝酸根(NO3),氯酸根(ClO3),高锰酸根(MnO4);
负二价:硫酸根(SO4),碳酸根(CO3),亚硫酸根(SO3),锰酸根(MnO4);
负三价:磷酸根(PO4);
正一价:铵根(NH4)。
三、熟记下列反应方程式:
(一)酸的性质(1)与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色。
(2)酸+碱=盐+水。
(3)酸+某些金属氧化物=盐+水。
(4)酸+活泼金属=盐+氢气。
(5)酸+盐=新盐+新酸。
1、锌跟稀盐酸反应:Zn+2HCl=ZnCl2+H2有气泡产生,锌粒逐渐减少。
2、锌跟稀硫酸反应:Zn+H2SO4=ZnSO4+H2
3、铁跟稀盐酸反应:Fe+2HCl=FeCl2+H2有气泡产生,铁逐渐减少,
4、铁跟稀硫酸反应:Fe+H2SO4=FeSO4+H2溶液变成浅绿色。
5、铁锈跟稀盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O红色铁锈逐渐消失,
6、铁锈跟稀硫酸反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O溶液变成黄色
7、氧化铜跟稀盐酸反应:CuO+2HCl=CuCl2+H2O黑色氧化铜逐渐消失,
8、氧化铜跟稀硫酸反应:CuO+H2SO4=CuSO4+H2O溶液变成蓝色。
(二)碱的性质:(1)碱溶液能使紫色石蕊试液变蓝色,无色酚酞试液变红色。
(2)碱+多数非金属氧化物=盐+水
(3)碱+酸=盐+水
(4)碱+某些盐=另一种盐+另一种碱
1、氢氧化钠跟二氧化碳反应:2NaOH+CO2=Na2CO3+H2O
2、氢氧化钠跟二氧化硫反应:2NaOH+SO2=Na2SO3+H2O
3、氢氧化钠跟三氧化硫反应:2NaOH+SO3=Na2SO4+H2O
4、氢氧化钙跟二氧化碳反应:Ca(OH)2+CO2=CaCO3+H2O使澄清石灰水变浑浊
5、氢氧化钠跟稀硫酸反应:2NaOH+H2SO4=Na2SO4+2H2O
6、氢氧化钠跟稀盐酸反应:NaOH+HCl=NaCl+H2O
7、生石灰跟水反应:CaO+H2O=Ca(OH)2
(三)盐的性质:(1)盐+某些金属=另一种盐+另一种金属。
(2)盐+某些酸=另一种盐+另一种酸。
(3)盐+某些碱=另一种盐+另一种碱
(4)盐+某些盐=另一种盐+另一种盐
1、硫酸铜溶液跟铁反应:CuSO4+Fe=ZnSO4+Fe铁表面覆盖红色物质,溶液由蓝色变浅绿色
2、碳酸钠跟盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2有气泡产生固体逐渐减少
3、碳酸氢钠跟盐酸反应:NaHCO3+HCl=NaCl+H2O+CO2有气泡产生固体逐渐减少
4、石灰石跟稀盐酸反应:CaCO3+2HCl=CaCl2+H2O+CO2有气泡产生固体逐渐减少
5、硝酸银跟稀盐酸反应:AgNO3+HCl=AgCl+HNO3有白色沉淀产生
6、氯化钡跟稀硫酸反应:BaCl2+H2SO4=BaSO4+2HCl有白色沉淀产生
7、氢氧化钙根碳酸钠溶液反应:Ca(OH)2+Na2CO3=2NaOH+CaCO3有白色沉淀产生
8、硝酸银溶液跟氢氧化钠溶液反应:AgNO3+NaCl=AgCl+NaNO3有白色沉淀产生
9、氯化钡溶液跟硫酸钠溶液反应:BaCl2+Na2SO4=2NaCl+BaSO4有白色沉淀产生
四、金属活动性顺序表:
KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu
五、溶解性表:
(1)大多数酸可溶(HCl、HNO3、H2CO3有挥发性、浓H2SO4有吸水性。)
(2)碱的溶解性:钾、钠、钡、铵溶、钙微溶,其余碱全不溶。
(3)盐的溶解性:
钾、钠、铵、硝四盐溶。
氯化物除AgCl不溶外,其余全溶。
硫酸盐除BaSO4不溶,Ag2SO4、CaSO4微溶外,其余全溶。
碳酸盐除钾、钠、铵盐全溶、MgCO3微外,其余全不溶。
六、反应条件:
1、复分解反应的条件--生成物中有沉淀析出,或有气体放出,或有水生成
2、金属跟酸反应的条件--
(1)在金属活动性顺序表中,金属要排在氢前。
(2)浓硫酸、硝酸跟金属反应不能生成氢气。
(3)铁发生置换反应时,生成+2价的铁的化合物。
3、金属跟盐反应的条件--
(1)在金属活动性顺序表中,单质的金属要比盐中金属活泼。
(2)反应物中的盐要可溶。
(3)K、Ca、Na、Ba等金属跟盐反应不能生成另一种盐和另一种金属。
4、盐跟盐反应的条件--反应物都要可溶,生成物要有沉淀。
5、盐跟碱反应的条件--反应物都要可溶,生成物要有沉淀或气体。
七、熟记常见物质的俗称和化学式:
生石灰--CaO熟石灰--Ca(OH)2石灰石、大理石--CaCO3
食盐--NaCl火碱、烧碱、苛性钠--NaOH纯碱、苏打--Na2CO3
小苏打--NaHCO3铁锈、赤铁矿--Fe2O3赤铁矿--Fe3O4
金刚石、石墨--C干冰--CO2冰--H2O
天然气(甲烷)--CH4酒精(乙醇)--C2H5OH醋酸(乙酸)--CH3COOH
八、熟记常见物质的颜色:
红色的固体--Cu、Fe2O3、P(红磷)
黑色的固体--C、CuO、Fe3O4、FeO、MnO2
白色的固体--KClO3、P2O5、P(白磷)、CuSO4(无水硫酸铜)、KCl、NaCl等
暗紫色的固体--KMnO4黄色的固体--S
蓝色的固体--CuSO4?5H2O蓝色絮状沉淀--Cu(OH)2
红褐色絮状沉淀--Fe(OH)3常见不溶于酸的白色沉淀--BaSO4、AgCl
溶于酸并放出使澄清石灰水变浑浊的气体的白色沉淀--BaCO3、CaCO3等不溶性碳酸盐的沉淀
溶于酸但不产生气体的白色沉淀--Mg(OH)2、Al(OH)3等不溶性碱的沉淀
蓝色的溶液--CuSO4、CuCl2、Cu(NO3)2等含Cu2+溶液
浅绿色的溶液--FeSO4、FeCl2等含Fe2+溶液
黄色的溶液--FeCl3、Fe2(SO4)3、Fe(NO3)3等含Fe3+溶液
九、物质的检验和鉴别:
1、检验稀盐酸(或Cl-)--取少量待检液体于洁净的试管中,滴入几滴AgNO3溶液和稀HNO3,有白色沉淀产生。
2、检验稀硫酸(或SO42-)--取少量待检液体于洁净的试管中,滴入几滴BaCl2溶液和稀HNO3,有白色沉淀产生。
3、检验CO32---取少量待检液体于洁净的试管中,滴入几滴稀HCl,有使澄清石灰水变浑浊的气体产生。
4、检验NH4+--取少量待检物于洁净的试管中,滴入适量NaOH溶液并加热,有使湿的红色石蕊试纸变成蓝色的气体产生。
5、鉴别稀盐酸和稀硫酸--分别取少量待检液体于两支洁净的试管中,各滴入几滴BaCl2溶液,有白色沉淀产生的原溶液是稀硫酸,无现象产生的原溶液是稀盐酸。
6、鉴别Ca(OH)2和NaOH溶液--分别取少量待检液体于两支洁净的试管中,分别通入CO2气体(或各滴入几滴Na2CO3溶液),有白色沉淀产生的原溶液是Ca(OH)2,无现象产生的原溶液是NaOH。
◎补充下列反应方程式:
1、氢氧化铜跟稀盐酸反应:Cu(OH)2+2HCl=CuCl2+2H2O蓝色沉淀消失
2、氢氧化铜跟稀硫酸反应:Cu(OH)2+H2SO4=CuSO4+2H2O变成蓝色溶液
3、氢氧化钠跟硫酸铜溶液反应:2NaOH+CuSO4=Na2SO4+Cu(OH)2有蓝色沉淀产生
4、氢氧化钠跟氯化铁溶液反应:3NaOH+FeCl3=Fe(OH)3+3NaCl有红褐色沉淀产生
◎判断溶液的酸碱性--用指示剂,溶液的酸碱度--用pH来表示。
01234567891011121314
中性酸性增强碱性增强
紫色石蕊无色酚酞
pH7为酸性显红色显无色
pH=7为中性显紫色显红色
pH7为碱性显蓝色显红色
◎干燥剂的选择:
1、浓硫酸可干燥:酸性气体(如:CO2、SO2、SO3、NO2、HCl、)
中性气体(如:H2、O2、N2、CO)
※不能干燥碱性气体(如:NH3)
2、氢氧化钠固体、生石灰、碱石灰可干燥:碱性气体(如:NH3)
中性气体(如:H2、O2、N2、CO)
※不能干燥酸性气体(如:CO2、SO2、SO3、NO2、HCl、)
3、无水硫酸铜固体遇水由白色变蓝色,可检验水的存在,并吸收水蒸气。
一些知识点
单质:非惰性气体一般由两个原子组成:F2,O2,H2,Cl2
惰性气体一般由一个原子组成:He,Ne,Ar,Kr,Xe
化合物:氢化物居多:H2S,HCl,H3P,HF,HBr,HI
初中化学溶液的酸碱性
1、显酸性的溶液:酸溶液和某些盐溶液(硫酸氢钠、硫酸氢钾等)
2、显碱性的溶液:碱溶液和某些盐溶液(碳酸钠、碳酸氢钠等)
3、显中性的溶液:水和大多数的盐溶液
酸碱盐知识口诀大全
《酸碱盐》知识系统性比较强,概念较多,涉及到的化合物种类及反应也多,且反应规律较复杂,同学们学习有一定困难。如果把。说明:该章的一些重要内容编成口诀,记忆起来就方便多了。初中化学第八章《酸碱盐》知识系统性比较强,概念较多,涉及到的化合物种类及反应也多,且反应规律较复杂,同学们学习有一定困难。如果把该章的一些重要内容编成口诀,记忆起来就方便多了。
1.电离口诀:电电离离,遇水便离遇水便离是指酸、碱、盐在溶解于水时便同时发生电离,并不是通电后才发生电离。
2.酸碱盐溶液导电原因口诀:溶液能导电,原因仔细辨,光有离子还不行,自由移动是关键。说明:光有离子还不行,自由移动是关键是指如果溶液中存在离子,若这些离子不能自由移动,该溶液仍不能导电。只有溶液中存在自由移动的离子时,溶液才能导电。
3.浓盐酸的特性口诀:无色刺激有酸味,浓酸挥发成白雾;要问白雾是什么,它是盐酸小液滴。说明:若将它是盐酸小液滴改为它是硝酸小液滴,即成为浓硝酸的特性。
4.浓硫酸的特性口诀:无色粘稠油状液,不易挥发把水吸;腐蚀皮肤使碳化,沾上硫酸用布拭。说明:把水吸是指浓硫酸有吸水性,从而推知浓硫酸可作干燥剂。沾上皮肤用布拭是指如果皮肤上沾上硫酸,应立即用布拭去,再用水冲洗。而不能象处理其它酸一样先用水洗。
5.指示剂遇酸、碱溶液变色口诀:石蕊遇酸紫变红,酚酞遇酸影无踪;石蕊遇碱紫变蓝,酚酞遇碱红艳艳。说明:影无踪是指无色酚酞试液遇酸不变色(仍为无色)。石蕊遇碱、酚酞遇碱,这里的碱是指碱溶液。若是不溶性碱,则不能使指示剂变色。
6.稀释浓硫酸的方法口诀:稀释浓硫酸,应防酸飞溅,要把浓酸注入水,同时再搅拌。说明:应防酸飞溅,是因为浓硫酸溶于水时会放出大量的热,如果把水注入浓硫酸里,水的密度较浓硫酸小,会浮在酸上面,溶解时放出的热会使水立即沸腾,使硫酸液滴向四周飞溅。
7.硝酸、浓硫酸跟金属反应口诀:硝酸浓硫酸,氧化性很强,遇到金属后,生水不生氢。说明:生水不生氢是指生成水而不生成氢气。
8.金属活动性顺序的意义及应用口诀:意义:金属位置越靠前,金属活动性越强。2应用:①金属跟酸的置换反应:氢前金属能置氢,氢后金属不反应。②金属跟盐的置换反应:前面金属是单质,后面金属盐溶液,除去钾钙钠钡外,置换反应都成立。说明:后面金属盐溶液是指排在后面的金属形成的盐必须是可溶性盐,不溶性盐不能跟金属发生置换反应。除去钾钙钠钡外是指在金属活动性顺序中,排在最前面的钾、钙、钠及金属钡的活性很强,将它们投放盐酸溶液中时,它们首先跟溶液中的水反应,而不能置换出盐中的金属,故应除去这四种金属。
9.氢氧化钠的特性及俗名口诀:白色易溶并放热,吸水潮解味道涩。由于腐蚀有俗名:火碱烧碱苛性钠。说明:易溶并放热是指氢氧化钠易溶于水,并在溶解时放出大量的热。
10.盐和碱的溶解性规律口诀:钾钠铵盐硝酸盐,溶入水中都不见。硫酸钡、氯化银,白色沉淀现象明。碳酸钾钠铵溶,碳酸铝铁影无踪。要问碱类溶多少,钾钠钡钙铵中找。说明:硫酸钡、氯化银,白色沉淀现象明是指硫酸盐中只有硫酸钡不溶,其余都溶;盐酸盐(即氯化物)中只有氯化银不溶,其余都溶。碳酸钾钠铵溶,碳酸铝铁影无踪是指碳酸盐中只有碳酸钾、碳酸钠、碳酸铵溶于水,碳酸铝、碳酸铁不存在或遇水便分解了,其余都不溶于水。要问碱类溶多少,钾钠钡钙铵中找是指碱类中只有氢氧化钾、氢氧化钠、氢氧化钡和氢氧化铵四种碱可溶,氢氧化钙微溶,其它碱都不可溶。
酸碱盐知识口诀大全
《酸碱盐》知识系统性比较强,概念较多,涉及到的化合物种类及反应也多,且反应规律较复杂,同学们学习有一定困难。如果把。说明:该章的一些重要内容编成口诀,记忆起来就方便多了。初中化学第八章《酸碱盐》知识系统性比较强,概念较多,涉及到的化合物种类及反应也多,且反应规律较复杂,同学们学习有一定困难。如果把该章的一些重要内容编成口诀,记忆起来就方便多了。
1.电离口诀:电电离离,遇水便离遇水便离是指酸、碱、盐在溶解于水时便同时发生电离,并不是通电后才发生电离。
2.酸碱盐溶液导电原因口诀:溶液能导电,原因仔细辨,光有离子还不行,自由移动是关键。说明:光有离子还不行,自由移动是关键是指如果溶液中存在离子,若这些离子不能自由移动,该溶液仍不能导电。只有溶液中存在自由移动的离子时,溶液才能导电。
3.浓盐酸的特性口诀:无色刺激有酸味,浓酸挥发成白雾;要问白雾是什么,它是盐酸小液滴。说明:若将它是盐酸小液滴改为它是硝酸小液滴,即成为浓硝酸的特性。
4.浓硫酸的特性口诀:无色粘稠油状液,不易挥发把水吸;腐蚀皮肤使碳化,沾上硫酸用布拭。说明:把水吸是指浓硫酸有吸水性,从而推知浓硫酸可作干燥剂。沾上皮肤用布拭是指如果皮肤上沾上硫酸,应立即用布拭去,再用水冲洗。而不能象处理其它酸一样先用水洗。
5.指示剂遇酸、碱溶液变色口诀:石蕊遇酸紫变红,酚酞遇酸影无踪;石蕊遇碱紫变蓝,酚酞遇碱红艳艳。说明:影无踪是指无色酚酞试液遇酸不变色(仍为无色)。石蕊遇碱、酚酞遇碱,这里的碱是指碱溶液。若是不溶性碱,则不能使指示剂变色。
6.稀释浓硫酸的方法口诀:稀释浓硫酸,应防酸飞溅,要把浓酸注入水,同时再搅拌。说明:应防酸飞溅,是因为浓硫酸溶于水时会放出大量的热,如果把水注入浓硫酸里,水的密度较浓硫酸小,会浮在酸上面,溶解时放出的热会使水立即沸腾,使硫酸液滴向四周飞溅。
7.硝酸、浓硫酸跟金属反应口诀:硝酸浓硫酸,氧化性很强,遇到金属后,生水不生氢。说明:生水不生氢是指生成水而不生成氢气。
8.金属活动性顺序的意义及应用口诀:意义:金属位置越靠前,金属活动性越强。2应用:①金属跟酸的置换反应:氢前金属能置氢,氢后金属不反应。②金属跟盐的置换反应:前面金属是单质,后面金属盐溶液,除去钾钙钠钡外,置换反应都成立。说明:后面金属盐溶液是指排在后面的金属形成的盐必须是可溶性盐,不溶性盐不能跟金属发生置换反应。除去钾钙钠钡外是指在金属活动性顺序中,排在最前面的钾、钙、钠及金属钡的活性很强,将它们投放盐酸溶液中时,它们首先跟溶液中的水反应,而不能置换出盐中的金属,故应除去这四种金属。
9.氢氧化钠的特性及俗名口诀:白色易溶并放热,吸水潮解味道涩。由于腐蚀有俗名:火碱烧碱苛性钠。说明:易溶并放热是指氢氧化钠易溶于水,并在溶解时放出大量的热。
10.盐和碱的溶解性规律口诀:钾钠铵盐硝酸盐,溶入水中都不见。硫酸钡、氯化银,白色沉淀现象明。碳酸钾钠铵溶,碳酸铝铁影无踪。要问碱类溶多少,钾钠钡钙铵中找。说明:硫酸钡、氯化银,白色沉淀现象明是指硫酸盐中只有硫酸钡不溶,其余都溶;盐酸盐(即氯化物)中只有氯化银不溶,其余都溶。碳酸钾钠铵溶,碳酸铝铁影无踪是指碳酸盐中只有碳酸钾、碳酸钠、碳酸铵溶于水,碳酸铝、碳酸铁不存在或遇水便分解了,其余都不溶于水。要问碱类溶多少,钾钠钡钙铵中找是指碱类中只有氢氧化钾、氢氧化钠、氢氧化钡和氢氧化铵四种碱可溶,氢氧化钙微溶,其它碱都不可溶。