2019中考化学知识点:金属的化学性质
发布时间:2019-07-15 23:10:07来源:查字典-中考网
2019中考化学知识点:金属的化学性质
金属与氧气的反应
镁、铝:
在常温下能与空气中的氧气反应:

铝的抗腐蚀性能好的原因:铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。
铁、铜
在常温下、干燥的环境中,几乎不与氧气反应,但在潮湿的空气中会生锈。
铁、铜在高温时能与氧气反应:

金即使在高温时也不与氧气反应。
金属与酸的反应:活泼金属+酸盐+H2
描述现象时,需要注意:①如果有铁、铜元素参加反应,一定要注意溶液颜色的变化;②反应放热,但是只有镁和酸反应时放热现象明显。
置换反应:由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应是置换反应。
当铁单质参加置换反应时,生成物中的铁元素呈+2价。
常见金属在溶液中的活动性顺序:
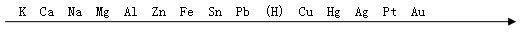
金属活动性由强逐渐减弱
在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸(不可以用浓硫酸和硝酸)中的氢。
在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
钾、钙、钠不符合这一条。它们会先和水反应生成碱和氢气,然后碱和盐反应。
金属与盐溶液的反应:金属+盐另一金属+另一盐(条件:前换后,盐可溶)
在活动性顺序中,金属的距离大的,反应先发生。一个置换反应结束后,另一个置换反应才会发生。如在硫酸亚铁和硫酸铜的混合溶液中加入锌粒,锌会先和硫酸铜反应,反应完毕后锌才和硫酸亚铁反应。
湿法冶金的反应原理:

Fe2+的盐溶液是浅绿色的,Fe3+的盐溶液是黄色的,Cu2+的盐溶液是蓝色的。
比较Cu、Fe、Ag三种金属的活动性顺序
使用铁、银和溶液,一次性得出结果:
操作及现象:把铁、银分别放入硫酸铜溶液中,铁表面没有现象;而银表面会附着一层红色物质,并且溶液会由蓝色逐渐变为无色。
使用铜、硫酸亚铁溶液和硝酸银溶液,一次性得出结果:
操作及现象:把铜分别放入硫酸亚铁溶液和硝酸银溶液中,硫酸亚铁溶液没有现象;而在硝酸银溶液中,铜表面会附着一层白色物质,溶液由无色逐渐变为蓝色。
选用试剂时,要根据金属活动性顺序表将三种金属排序,然后将排在中间的金属变成盐溶液,或者将排在两边的金属变成盐溶液,这样才能一次性得出结果。